依據歐盟施行的個人資料保護法,我們致力於保護您的個人資料並提供您對個人資料的掌握。
按一下「全部接受」,代表您允許我們置放 Cookie 來提升您在本網站上的使用體驗、協助我們分析網站效能和使用狀況,以及讓我們投放相關聯的行銷內容。您可以在下方管理 Cookie 設定。 按一下「確認」即代表您同意採用目前的設定。
Latest News
中銀文摘
2021-04-26
化妝品、食品、藥物與醫療器材法律專區
台灣醫療器材管制政策——以醫療器材管理法為中心(上)
【中銀律師事務所 吳婕華合夥律師 / 楊明瑜律師】
charlotte.wu@zhongyinlawyer.com.tw
charlotte.wu@zhongyinlawyer.com.tw
前言
在2020年產值規模高達4200億美元的醫療器材產業[1],商機、使用者安全,與政府管理之各方面安排,造就了不同國家對於醫療器材管理政策的面貌,在醫療器材管制政策變革即醫療器材管理法施行的前夕,且讓我們再度回顧台灣醫療器材管制的前世今生。
至目前為止,醫療器材的管制仍以藥事法作為法律位階的管制基礎,在法體系下則有包括醫療器材管理辦法、醫療器材查驗登記審查準則、人體試驗管理辦法、藥物委託製造及檢驗辦法等法規命令,以及醫療器材採認標準、醫療器材臨床前測試基準等等標準與指引所構成之管制模式[2]。
為因應台灣社會已邁入高齡化、數位化以及資訊化等階段,舊有將醫療器材與藥物併同以藥事法統一管制之模式恐不敷現實需求,在市場業者與行政機關歷經無數次的溝通與召開公聽會的結果,於立法院也歷經七次版本的討論[3],終於在2019年12月通過醫療器材管理法,明確地將醫療器材的管制從藥事法中抽離[4],希望透過以彈性效率及產品安全並進之管制基礎,為醫療器材研發到上市的市場生命週期打造制度,期盼能推動我國醫療器材產業之健全以及邁向國際化[5]。
筆者將本篇文章區分上下二篇,首篇將著重於新醫療器材管理法之相關規範簡介,希望使讀者對於新制度有初步了解;次篇則著重於對於新制之相關市場研析等需求、評論等,簡介我國醫療器材規管制度的變革。
現行醫療器材規範之齟齬
如同前述,現行的醫療器材規範主要的法律體系是以藥事法為中心,及法體系以下之各種法規命令及行政規則等,主管機關為衛生福利部食品藥物管理署。任何醫療器材進入市場前,除了業者應取得相關之藥商許可執照[6]外,針對個別醫療器材,該藥商應依法辦理醫療器材查驗登記[7],以取得販售或輸入醫療器材許可證。該許可證之有效期間為五年,期滿後仍須繼續製造、輸入者,應事先申請中央主管機關核准展延之,但每次展延不得超過五年[8]。
針對醫療器材的分類管理,現行的管理方式係依照風險等級分為三種等級,第一等級為低風險性,例如醫用口罩、紗布、彈性繃帶等;第二等級為中風險性,例如電子體溫計、血糖機、衛生棉條等;第三等級為高風險性,例如冠狀動脈支架、人工水晶體、心律調節器等。另外依據功能、用途、使用方法及工作原理,共分為臨床化學及臨床毒理學、血液學及病理學、麻醉學、心臟血管醫學等17類[9]。
在醫療器材上市後,依現行制度則依照不良反應通報系統[10]、安全性監視[11]等制度性監督該許可之醫療器材上市後之情形,為病患或醫療器材使用者之權益把關。
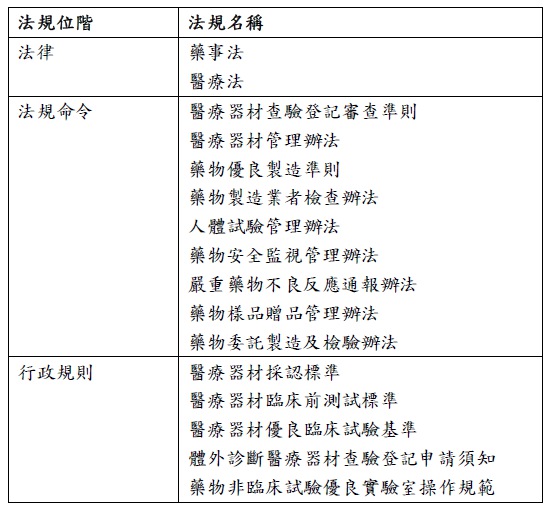
上表為在醫療器材管理法施行前制度情形
醫療器材管理法催生的契機
隨著健康產業逐漸普及化、多元化的趨勢,現有的醫療器材管制模式似乎未能因應市場各式各樣產品的法遵需求。以市面上智慧穿戴裝置為例,由於人體生物特徵數據經大數據或人工智慧之處理,得作為業者提供更多服務或日常保健建議之參考,惟監測該等數據之儀器或功能,卻可能因為在屬性判定上可能被主管機關認定為係醫療器材而應取得相關行政許可,導致在台灣的使用者僅能使用該智慧穿戴裝置部分之功能,於全世界同一產品之使用者間,似乎成為「次等公民」之感受。
另外,以醫療器材相關之軟體設計為例,軟體設計工程於現行法規是否應歸類於醫療器材製造業者已有疑義,且依現行藥事法規範,醫療器材製造業者應依法辦理工廠登記,故這種針對醫療器材使用的軟體公司,其如果按現行規範,恐因未依法辦理工廠登記完成法律遵循義務,而無法進行產品的設計與販售,此種在市場現實與法規範間之斷裂,亦成為醫療器材管理制度修正之契機。
故在種種因素的催化下,產品生產者、消費者以及政府對於現行醫療器材管理制度便有了不同之想像與願景,行政院在2017年提出醫療器材管理法草案,歷經不同版本的討論以及經過無數次的溝通、研討的結論下,於2019年12月,終於催生了新的醫療器材管理法,將醫療器材獨立於藥事法,從醫療器材的市場生命歷程出發,量身打造應適用的規範,以彌補現行法規之不足。
筆者將於本文章之下篇,繼續簡介新制規範。

如您對上述的內容有任何意見或有興趣進一步瞭解,歡迎您聯繫我們。
Charlotte J.H. Wu 吳婕華律師
charlotte.wu@zhongyinlawyer.com.tw
TEL +886 2 2377 1858 EXT 8888
[1] 全球醫療器材市場估達4200億美元 智慧健康照護發展快速,2020,社團法人國家生技醫療產業策進會,取自:https://ibmi.taiwan-healthcare.org/news_detail.php?REFDOCTYPID=&REFDOCID=0qj5ad0bvke3f2sf。
[2] 筆者僅臚列一部份之藥事法子法以及相關行政規則,上述規定並未涵蓋全部。
[3] 除了行政院版本外,於立法院亦有由委員陳曼麗、親民黨黨團、吳焜裕、黃秀芳、王育敏、劉建國提出等版本
[4] 醫療器材管理法第83條:自本法施行之日起,醫療器材之管理,應適用本法之規定,藥事法有關醫療器材之規定,不再適用。
[5] 食品藥物管理署新聞稿,2019-12-13,立法院三讀通過醫療器材管理法草案,醫療器材產業邁入新紀元- 衛生福利部 (mohw.gov.tw)。
[6] 國產(製造)業者須取得「製造業藥商許可執照」,進口(輸入)業者須取得「販賣業藥商許可執照」。
[7] 現行藥事法第40條。
[8] 藥事法第47條。
[9] 醫療器材管理辦法第2條及第3條。
[10] 藥事法第45條、嚴重藥物不良反應通報辦法。
[11] 藥事法第45條、藥物安全監視管理辦法。




